Resultat: Bubblade på alla metaller. Saltsyrans lukt var stark och stickande. Det small när man eldade över provröret med frätande magnesium.
Slusats: Det måste bildats vätgas när metaller metallerna kommer i saltsyra. De reagerar olika bara för att metallerna är olika ädla. Magnesium är den mest oädla metallen.
fredag 25 januari 2013
torsdag 24 januari 2013
baser med jakob
Hydroxidjoner: Hydroxidjoner gör ett ämne basiskt. Om ett ämne är neutralt så finns det lika mycket vätejoner som hydroxidjoner. Om ämnet är surt finns det mer vätejoner än hydroxidjoner och tvärt om.
NaOH (Natriumhydroxid): Natriumhydroxid är ett salt. Om man löser salt i vatten så skildrar sig dom negativa och dom positiva jonerna. I natriumhyrdoxid kommer natriumjonerna vilja skilja sig från hydroxidjonerna. NaOH ----> Na+ + OH-. Hydroxidjonerna gör lösningen basiskt och natriumjonerna gör den stark. Det blir alltså en stark bas.
Ammoniak: Ammoniak är en bas. Den kemiska beteckningen för ammoniak är NH3. Ammoniak har en stark och stickande lukt. Om man löser ammoniak i vatten bildas Ammoniumhydroxid.
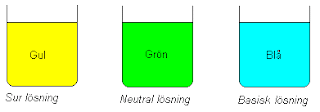
BTB(Bromtymolblå): BTB är en förkortning för bromtymolblå. BTB är en indikator som visar om någonting är surt eller basiskt. Så om man droppar i några droppar med BTB i en lösning så kommer lösningen få någon av dessa färgerna.
Ett ämne är en bas om den har över PH 7,0. En syra har PH under 7,0. En neutral lösning har PH 7,0.
Alla baser innehåller hydroxidjoner.
NaOH (Natriumhydroxid): Natriumhydroxid är ett salt. Om man löser salt i vatten så skildrar sig dom negativa och dom positiva jonerna. I natriumhyrdoxid kommer natriumjonerna vilja skilja sig från hydroxidjonerna. NaOH ----> Na+ + OH-. Hydroxidjonerna gör lösningen basiskt och natriumjonerna gör den stark. Det blir alltså en stark bas.
Ammoniak: Ammoniak är en bas. Den kemiska beteckningen för ammoniak är NH3. Ammoniak har en stark och stickande lukt. Om man löser ammoniak i vatten bildas Ammoniumhydroxid.
BTB(Bromtymolblå): BTB är en förkortning för bromtymolblå. BTB är en indikator som visar om någonting är surt eller basiskt. Så om man droppar i några droppar med BTB i en lösning så kommer lösningen få någon av dessa färgerna.
Ett ämne är en bas om den har över PH 7,0. En syra har PH under 7,0. En neutral lösning har PH 7,0.
Alla baser innehåller hydroxidjoner.
torsdag 17 januari 2013
Syror i samarbete med Jakob!
Saltsyra: Den kemiska beteckningen för saltsyra är HCl. Saltsyra kan ofta ryka som resultat av att syran lämnar vätskan i gasform. Saltsyra är en vattenlösning av en gas som heter väteklorid. Saltsyra är starkt frätande och har en stark och stickande lukt.
Vätejon: Vätejoner finns i alla syror, men vissa släpper ifrån sig vätejoner ibland medan andra släpper ifrån sig vätejoner ofta. Om en syra släpper ifrån sig vätejoner ofta så är det en stark syra. Om en syra bara släpper ifrån sig vätejoner ibland så är det en svag syra.
Svavelsyra: Den kemiska beteckningen för Svavelsyra är H2SO4. Svavelsyra luktar inte. Den har ganska hög densitet och kan verka aningen seg. Svavelsyra är lite speciell för den absorberar vatten. Den har man tidigare använt den till att absorbera fukt i mellanfönster.
Salpetersyra: Den kemiska beteckningen för Salpetersyra är HNO3. Salpetersyra måste förvaras där det är mörkt annars kan den sönderdelas av solljus. Salpetersyra kan gulfärga proteiner. Man kan se det genom att droppa lite av syran på sin nagel. Efter ett tag så färgas nageln gul. Detta är för att syran reagerar med oädla metaller. Då avges gaser som kallas nitrösa gaser. Dessa är mycket giftiga.
Ättiksyra: Den kemiska beteckningen för Etansyra/Ättiksyra är CH3COOH. Ättiksyra stelnar redan vid 17°C. Ättiksyra kan framställas genom många kemiska reaktioner. T.ex genom torrdestillation av trä eller genom att etanol omvandlas under inverkan av vissa bakterier. Ättiksyra används vid inläggning av t.ex gurka och kan användas som fönsterputs.
Ättiksyra är en svag syra.
Mjölksyra: Det finns två sorters mjölksyra, Den som produceras i kroppen när vi anstränger oss och den som används till fil och yogurt. Mjölksyran som finns i mjölkprodukterna är inte tillverkad av mjölk. Den tillverkas av stärkelse från potatis och majs. Den kemiska betäckningen för mjölksyra är C3H4O(OH)2
Vätejon: Vätejoner finns i alla syror, men vissa släpper ifrån sig vätejoner ibland medan andra släpper ifrån sig vätejoner ofta. Om en syra släpper ifrån sig vätejoner ofta så är det en stark syra. Om en syra bara släpper ifrån sig vätejoner ibland så är det en svag syra.
Svavelsyra: Den kemiska beteckningen för Svavelsyra är H2SO4. Svavelsyra luktar inte. Den har ganska hög densitet och kan verka aningen seg. Svavelsyra är lite speciell för den absorberar vatten. Den har man tidigare använt den till att absorbera fukt i mellanfönster.
Salpetersyra: Den kemiska beteckningen för Salpetersyra är HNO3. Salpetersyra måste förvaras där det är mörkt annars kan den sönderdelas av solljus. Salpetersyra kan gulfärga proteiner. Man kan se det genom att droppa lite av syran på sin nagel. Efter ett tag så färgas nageln gul. Detta är för att syran reagerar med oädla metaller. Då avges gaser som kallas nitrösa gaser. Dessa är mycket giftiga.
Ättiksyra: Den kemiska beteckningen för Etansyra/Ättiksyra är CH3COOH. Ättiksyra stelnar redan vid 17°C. Ättiksyra kan framställas genom många kemiska reaktioner. T.ex genom torrdestillation av trä eller genom att etanol omvandlas under inverkan av vissa bakterier. Ättiksyra används vid inläggning av t.ex gurka och kan användas som fönsterputs.
Ättiksyra är en svag syra.
Mjölksyra: Det finns två sorters mjölksyra, Den som produceras i kroppen när vi anstränger oss och den som används till fil och yogurt. Mjölksyran som finns i mjölkprodukterna är inte tillverkad av mjölk. Den tillverkas av stärkelse från potatis och majs. Den kemiska betäckningen för mjölksyra är C3H4O(OH)2
Det finns en regel som heter SIV. Syra i vatten. Den betyder att man bara får hälla syra i vatten och inte tvärt om. Häller man vatten i syra kan det bli varmt och börja koka. Det kan även explodera.
Alla syror innehåller vätejoner.
Prenumerera på:
Inlägg (Atom)